Molekularer Wasserstoff und seine therapeutische Wirksamkeit bei neurodegenerativer Erkrankungen
von Md. Habibur Rahman1,2,Johny Bajgai1,Ailyn Fadriquela1,Subham Sharma
Subham Sharma, ScilitPreprints.orgGoogle Scholar
1,2,Thuy Trinh Thi1,2,Rokeya Akter
2,Seong Hoon Goh1,Cheol-Su Kim1UndKyu-Jae Lee1,*
Abteilung für Umweltmedizinische Biologie, Wonju College of Medicine, Yonsei University, Wonju 26426, Gangwon-do, Korea
Department of Global Medical Science, Yonsei University Wonju College of Medicine, Yonsei University, Wonju 26426, Gangwon-do, Korea
Prozesse 2021 , 9 (2), 308; https://doi.org/10.3390/pr9020308
Abstrakt
Oxidativer Stress (OS) und neuroinflammatorischer Stress beeinflussen viele neurologische Erkrankungen. Trotz der klinischen Bedeutung oxidativer Schäden bei neurologischen Erkrankungen stehen noch keine wirksamen und sicheren Behandlungsmethoden für Neuroerkrankungen zur Verfügung. Daher wurde kürzlich über molekularen Wasserstoff (H 2 ) als Antioxidans und entzündungshemmendes Mittel zur Behandlung mehrerer durch oxidativen Stress verursachter Krankheiten berichtet. In klinischen Versuchen an Tieren und Menschen werden die Wege der H2 - Verabreichung hauptsächlich in drei Arten eingeteilt: H2 - Gas-Inhalation, H2 - Wasserlösung und H2 - gelöste Kochsalzlösung-Injektion. In diesem Aufsatz werden einige bedeutende Fortschritte in der H2-Forschung untersuchtVerwendung bei neurodegenerativen Erkrankungen (NDs), einschließlich Alzheimer-Krankheit, Parkinson-Krankheit, neonatalen Erkrankungen des Gehirns und anderen NDs (retinale Ischämie und traumatische Hirnverletzung). Auch wenn die meisten neurologischen Probleme derzeit nicht heilbar sind, haben diese Studien das therapeutische Potenzial zur Vorbeugung, Behandlung und Linderung der H2- Verabreichung gezeigt. Mehrere mögliche H 2 -Effektoren, darunter Zellsignalmoleküle und Hormone, die OS und Entzündungen verhindern, werden ebenfalls angesprochen. Allerdings sind weitere klinische und andere verwandte Studien erforderlich, um das direkte H 2 -Zielmolekül zu bewerten.
Schlüsselwörter:molekularer Wasserstoff ; Entzündung ; Neuroprotektion ; neurologische Störung ; oxidativer Stress ; Antioxidans
1. Einleitung
Neurodegenerative Erkrankungen (NDs) sind Gruppen verschiedener Altersstörungen, die im Allgemeinen zu einem allmählichen Absterben und einer Zunahme neuronaler Zellen führen, was bei betroffenen Personen zu einer Beeinträchtigung der motorischen und Gedächtnisfunktion führt [ 1 ] . Der genaue Mechanismus für die Pathogenese von NDs bleibt weitgehend ungeklärt; Neue Erkenntnisse deuten jedoch darauf hin, dass oxidativer Stress (OS) eine wichtige Rolle bei der Pathogenese zahlreicher hirnbezogener Erkrankungen spielt, darunter Alzheimer-Krankheit (AD), Parkinson-Krankheit (PD), zerebrale Ischämie und andere Hirnverletzungen [ 2 , 3 , 4]. Für unsere Zellen ist es wichtig, einen moderaten Gehalt an reaktiven Sauerstoffspezies (ROS) aufrechtzuerhalten, um normale biologische Funktionen auszuführen. Allerdings ist eine starke Produktion von ROS für die Ursache oxidativer Schäden verantwortlich, die zur Apoptose führen können [ 5 ]. Diese übermäßige Produktion von ROS scheint eine mögliche Ursache für strukturelle und funktionelle Veränderungen zellulärer Biomoleküle, einschließlich Proteinen, Desoxyribonukleinsäure (DNA) und Lipiden, zu sein und schränkt somit letztendlich die neuronale Funktion und das Überleben ein und wird häufig im Gehirn von Patienten beobachtet neurodegenerative Erkrankungen [ 3 , 4 ]. Das Zentralnervensystem (ZNS) nutzt große Mengen Sauerstoff, um physiologische Prozesse durchzuführen, was zur Bildung reichlicher Mengen an freien Radikalen führt [5 ]. Endogene Antioxidantiensysteme, wie beispielsweise Superoxiddismutase (SOD), Katalase (CAT), Glutathionperoxidase (GPx) und Glutathion, spielen eine wichtige Rolle bei der Rettung von Gehirnzellen vor OS und bewahren das korrekte Redoxgleichgewicht im Gehirngewebe , indem es antioxidative Abwehrmechanismen stimuliert, um ROS auszugleichen. Diese enzymatischen Antioxidantien sind kettenbrechende Antioxidantien, die radikale Spezies abfangen können [ 6 ]. Manganhaltiges SOD verringert das Superoxidradikalanion, das während der Elektronentransportkette in der mitochondrialen Matrix entsteht, während CAT und/oder GPx eine Schlüsselrolle bei der Zersetzung von Wasserstoffperoxid in Wasser und Sauerstoff spielen [6, 7 ] .]. Verschiedene Studien haben über verringerte antioxidative Enzymaktivitäten wie CAT und SOD bei neurologischen Erkrankungen, einschließlich Parkinson, berichtet [ 8 , 9 ]. Interessanterweise zeigte eine Studie, dass eine Beeinträchtigung der SOD-Aktivität zu einer möglichen Pathogenese im Zusammenhang mit dem OS bei PD und AD führt [ 10 ]. Darüber hinaus hat die Forschung gezeigt, dass eine Zurückhaltung der CAT-Aktivität zu einer erhöhten Zytotoxizität und einem erhöhten ROS führt, was eine wesentliche Rolle von CAT bei der Aufrechterhaltung des oxidativen Gleichgewichts darstellt [ 11 ].
Neue Erkenntnisse unterstreichen und bestätigen deutlich die Rolle des OS bei der Pathogenese von NDs [ 2 , 3 , 4 ]. Daher waren Forscher in den letzten Jahren daran interessiert, die Rolle von Antioxidantien bei der Vorbeugung und Linderung dieser Krankheiten zu untersuchen. Es ist eine allgemein anerkannte Tatsache, dass natürliche Antioxidantien und antioxidative Enzyme eine Schlüsselrolle bei der Reduzierung zellulärer ROS spielen [ 12 ]. In jüngster Zeit hat molekularer Wasserstoff (H 2 ) im medizinischen Bereich als nicht funktionelles Gas, das sicher und wirksam ist und OS abschwächt, große Aufmerksamkeit auf sich gezogen, indem es als Radikalfänger für Hydroxylradikale (•OH) und Peroxynitrit (ONOO-) fungiert [ 13]. Verschiedene Studien haben die vorteilhaften Wirkungen von H 2 bei der Reduzierung der Pathophysiologie verschiedener Krankheiten durch Reduzierung des OS hervorgehoben [ 13 , 14 ]. Es gibt zahlreiche bequeme und wirksame Wege zur Verabreichung von H 2 , wie zum Beispiel Inhalation, orale Aufnahme von wasserstoffreichem Wasser (HRW), Injektion von wasserstoffreicher Kochsalzlösung (HS) und direkte Einarbeitung (Bad, Augentropfen und andere) [ 14 , 15 ]. H 2 wurde als therapeutisches Gas in einem Rattenmodell für Ischämie-Reperfusions-Hirnverletzungen (IR) beschrieben und es wurde berichtet, dass es in einem Modell der weißen Substanz des Gehirns eine vorbeugende Wirkung auf IR-Verletzungen in Sehnerven hat [16 ] . Darüber hinaus ist die Schutzwirkung von H 2im Trinkwasser durch die antioxidative Wirkung dopaminerger Neuronen in der Substantia nigra pars compacta (SNpc) wurde in einem Tiermodell untersucht [ 17 ]. Interessanterweise zeigte eine andere Studie außerdem, dass das Trinken von H 2 -gelöstem Wasser (HW) und die intermittierende H 2- Exposition die PD-Neurotoxizität verhindern [ 18 ]. Eine von Nagatani und Kollegen durchgeführte klinische Studie zeigte, dass die intravenöse Verabreichung von HRW für Patienten mit akutem Hirninfarkt sicher war, einschließlich derjenigen, die mit einem Gewebeplasminogenaktivator behandelt wurden [ 19 ] . Darüber hinaus zeigte eine Studie, dass das Einatmen von H 2Gas verbarg einen hirnschädigungsinduzierten Verschluss des mittleren Gehirns bei Ratten, erhöhte die kognitiven Werte und verringerte die Hirnschädigung bei Patienten mit akutem Hirninfarkt [ 20 ]. In verschiedenen klinischen und präklinischen Studien zu leichten kognitiven Beeinträchtigungen wurde festgestellt, dass H 2 heilende und ergogene Wirkungen hat [ 21 , 22 ]. Die meisten Hirnverletzungen in unserem Nervensystem reagieren auf eine Neuroinflammation, die sich durch phänotypische Veränderungen in Mikroglia und Astrozyten sowie eine übermäßige Produktion von freien Radikalen, Zytokinen und Neurotrophinen auszeichnet. Es gibt Hinweise darauf, dass die Regulierung des Redoxstatus der Mikroglia eine wesentliche Rolle bei der Modulation der neuroinflammatorischen Reaktion spielt [ 23] .]. Studien haben gezeigt, dass der regelmäßige Konsum von HW die Intensität akuter Verhaltensfolgen verringert und die Erholung von einer Neuroinflammation fördert [ 24 ]. H 2 kann die Aktivierung von proinflammatorischen Zytokinen, Mikroglia und 8-Hydroxy-2-desoxyguanosin (8-OHdG) reduzieren, um oxidative Schäden und Neuroinflammationen im fetalen Gehirn in Tiermodellen zu reduzieren [24 , 25 ] . Darüber hinaus zeigte eine Studie, dass HW eine schützende Wirkung gegen neonatale hypoxische Ischämie-Enzephalopathie hat, indem es die Spiegel der neuronenspezifischen Enolase im Serum, von Interleukin-6 (IL-6) und des Tumornekrosefaktors-α (TNF-α) senkt [ 26 ]. Daher beleuchtet dieser Übersic
2. Eigenschaften von molekularem Wasserstoff
H 2 wirkt als moderates, aber wirksames Antioxidans [ 13 , 27 ]. Wasserstoff ist das am häufigsten vorkommende Element der Welt und macht etwa 75 % der Weltmasse aus. Wasserstoff kommt in Wasser sowie in organischen und anorganischen Verbindungen vor. H 2 -Gas ist ein farbloses, geruchloses und brennstoffintensives zweiatomiges Gas. In der Erdatmosphäre gibt es weniger als 1 ppm Wasserstoffgas [ 28 ]. H 2 reagiert bei Raumtemperatur nicht mit den meisten Verbindungen, einschließlich Sauerstoffgas. H 2 -Gas ist erst bei Temperaturen über 537 °C brennbar. H 2 (4–75 %, v/v ) ist aufgrund der schnellen Oxidationskettenreaktion explosiv. H 2kann in Wasser unter Atmosphärendruck bis zu 0,8 mM (1,6 ppm, w/v ) gelöst werden [ 28 ].
In den letzten Jahren haben verschiedene Studien zu H 2 aufgrund seiner schützenden und therapeutischen Wirkung weltweit die Aufmerksamkeit von Forschern auf sich gezogen [ 14 , 15 ]. Darüber hinaus hat Wasserstoff im Hinblick auf seine Toxizität einen größeren Vorteil gegenüber anderen Gasen, die für medizinische Zwecke verwendet werden. Wasserstoff bleibt bis zu hohen Konzentrationen ungiftig und wird sogar in Tauchanwendungen eingesetzt [ 29 , 30 ]. Studien haben ergeben, dass die Auswirkungen der Wasserstoffinhalation nicht offensichtlich sind und keinen Einfluss auf den Blutdruck oder andere Parameter wie pH-Wert und Temperatur haben. Somit hat Wasserstoff im Vergleich weniger Nebenwirkungen als andere Antioxidantien, da es lediglich die •OH-Konzentration verringert [ 13 , 31 ].
3. Verabreichungswege
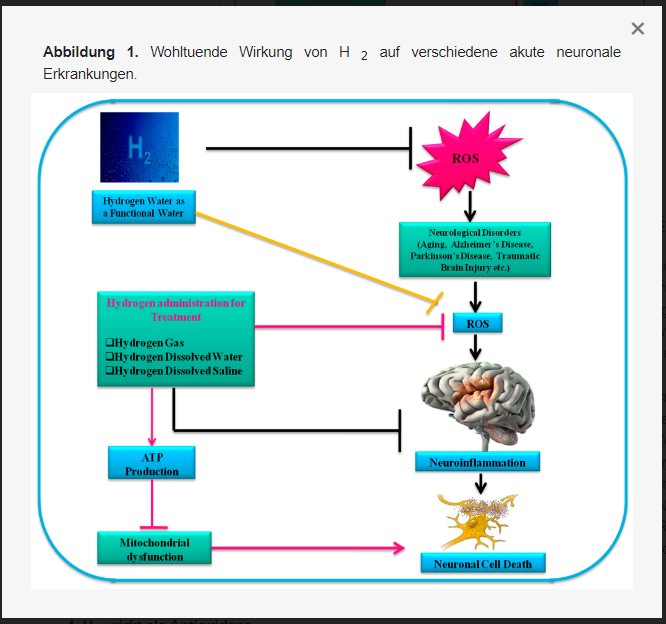
H 2 kann auf verschiedenen Wegen verabreicht oder in den Körper aufgenommen werden. Diese Wege können in drei Typen unterteilt werden: H2 - Gas-Inhalation, Trinken von HW und HS-Injektion. Die H2 - Gasinhalation ist die einfachste und am häufigsten verwendete Methode seit den ersten Berichten über die Verwendung von H2 [ 13 ] . Inhaliertes H 2 diffundiert in die Lungenbläschen und wird in den gesamten Körper transportiert. Dieses Verfahren kann jedoch unangenehm und sogar gefährlich sein, da H 2 -Gas bei Konzentrationen über 4 % in der Luft explosiv ist [ 27 ]. Daher wird die Mischgaskonzentration von H 2 üblicherweise zwischen 1 % und 4 % gehalten. Einatmen von H 2 Gas verbessert akute Zustände wie Ischämie-Reperfusionsschäden (IRI) und mehrere Verletzungen durch Organtransplantate. HRW ist sicherer und komfortabler als die H2 - Gasinhalation. Es wurde berichtet, dass HW ad libitum Arteriosklerose bei Mäusen mit Knockout-Apolipoprotein E verhindert, einem Modell für Atherosklerose, die sich spontan entwickelt [ 32 ]. Der Verbrauch von H 2 verhindert stressbedingte Beeinträchtigungen bei Hippocampus-abhängigen Lernaufgaben während chronischer körperlicher Zurückhaltung bei Mäusen [ 33 ]. Kürzlich zeigten die Inhalation von H2 und der Konsum von HW unterschiedliche Anpassungen der Signal- und Genexpression bei Mäusen [ 34]. ]. Obwohl der Prozess invasiv ist, war die neuroprotektive Wirksamkeit im Gehirn nach der intraperitonealen IRI-Injektion von HS ähnlich der der H2- Gasinhalation [ 35 ]. Im menschlichen Magen-Darm-Trakt wird H 2 von Darmbakterien produziert und spielt eine Schlüsselrolle in Stoffwechselwegen. Es fungiert als ausgeprägtes Antioxidans und beugt Herz-Kreislauf-Erkrankungen vor [ 15 ]. Eine der Studien zeigte, dass Darmbakterien eine Rolle beim Fortschreiten neurologischer Erkrankungen spielen. In diesem Zusammenhang wurde festgestellt, dass Patienten, die an verschiedenen ZNS-Erkrankungen litten, eine erhöhte Darmpermeabilität aufwiesen, die eine Passage schädlicher Metaboliten aus dem Darm ins Blut ermöglicht, die sich schädlich auf das ZNS auswirken [36] . ]. Eine Studie zeigte, dass die orale Verabreichung von HW zu schützenden Wirkungen in Ratten- und Mäusemodellen der Parkinson-Krankheit führt [ 17 ]. Diese Ergebnisse zeigen den potenziellen Einsatz von HRW zur Abwehr von NDs sowie die Möglichkeit, HRW zur Behandlung akuter Hirnstörungen einzusetzen. wie in Abbildung 1 dargestellt .[ 13 , 31 ].
Der mit dem Kernfaktor Erythroid 2 in Zusammenhang stehende Faktor 2 (Nrf2)-Signalweg spielt eine wichtige Rolle beim Schutz der Zellen vor verschiedenen Stressfaktoren und seine Funktionsstörung korreliert mit einer verringerten OS-Toleranz [ 37 ]. Nrf2 ist ein wichtiger Abwehrmechanismus des Gehirns gegen Toxine sowohl in Gliazellen als auch in neuronalen Zellen [ 38 , 39 ]. Der Nrf2-Signalweg zielt auf verschiedene Gene ab, beispielsweise Hämoxygenase-1 (HO-1), Glutathion-S-Transferase, SOD, CAT, NAD(P)H-Dehydrogenase(Chinon)1 und andere, und schützt so die Neuronen des ZNS davor Betriebssystem [ 40 , 41 ]. Nrf2 und verschiedene antioxidative Enzyme können auch die Expression von entzündungshemmenden Mediatoren, medikamentenmetabolisierenden Enzymen der Phase I und II und mitochondrialen Signalwegen erhöhen [ 42 , 43 ]. Jüngste Forschungsstudien haben gezeigt, dass Nrf2 sowohl in In-vitro- als auch in In-vivo-Modellen der Parkinson-Krankheit eine Abwehrwirkung gegen Neurotoxine wie 6-Hydroxydopamin und 1-Methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridin (MPTP) ausübt [ 44 , 45 ]. In diesem Zusammenhang hat die orale Verabreichung von HRW eine neuroprotektive Wirkung gegen traumatische Hirnverletzungen (TBI) durch Aktivierung des Nrf2-Signalwegs gezeigt. Darüber hinaus wurden ähnliche Ergebnisse bei verschiedenen NDs wie Parkinson, AD, IR und hämorrhagischem Schlaganfall berichtet, und die Auswirkungen werden auf die antioxidativen Eigenschaften von HRW zurückgeführt [ 46 , 47 , 48 ].
4. H2 wirkt als Antioxidans
H 2 ist hochreaktiv, denaturiert Proteine und fördert den DNA-Abbau. Es kann •OH und ONOO- selektiv reduzieren und so eine weit verbreitete Reaktion mit Proteinen, Lipiden und Nukleinsäuren hervorrufen [ 49 ]. Basierend auf Tiermodellen und klinischen Beobachtungen hat eine Reihe von Beweisen gezeigt, dass H 2 effizient zum Schutz vor oxidativen Schäden eingesetzt werden kann, die mit Krankheiten einhergehen [ 50 ]. Es verringert die Menge an zytotoxischen ROS (•OH) und verteidigt Zellen erfolgreich [ 50 ]. Andere Studien zeigten ähnliche Schutzwirkungen von H 2 gegen IRI in Organen wie Leber, Herz und Darm [ 51 ]. In Rattenmodellen für akuten Schlaganfall 1 % bis 4 % H 2Inhalation lindert Infarktausmaße [ 52 ]. Die H2 - Inhalation verhindert kritische oxidative Schäden in 1–3 % der Fälle [ 53 ]. Die Aufnahme von HRW schwächt Lern- und Gedächtnisstörungen bei Mäusen ab, indem es oxidative Schäden reduziert. Eine niedrige Gasatmung (1,3 V/100 V) reduziert Berichten zufolge das OS, eine außergewöhnliche Hypoxie-induzierte Dyslipidämie, eine Kardiomyozyten-Hypertrophie und eine perivaskuläre Fibrose im linken Ventrikel bei C57BL/6J-Mäusen [54 ] . Darüber hinaus löst die Aufnahme von HRW den Nrf2/Antioxidans-Schutzweg und die antioxidative Genexpression aus, um die Verringerung der Mundschleimhautbeeinträchtigung bei Ratten zu beschleunigen [ 55] .]. In ähnlicher Weise zeigten die Ergebnisse einer anderen Studie, dass HRW eine positive Wirkung auf akute Hautwunden bei Ratten hatte, die durch Strahlung verursacht wurden [ 56 ]. Derzeit werden mehrere Ersatzwege als Hauptkomponenten der energiemoderierenden Eigenschaften von H 2 untersucht , darunter: (1) Ghrelin-verknüpfte Hochregulierung des Ghrelinrezeptors (GHS-R1α); (2) Ghrelin-verknüpfte Motivation des Glukosetransporters 1; (3) nicht-Ghrelin-verknüpfte Stimulation des Glukosetransporters 4; und (4) nicht mit Ghrelin verbundene verbesserte Expression des Fibroblasten-Wachstumsfaktors 21 (FGF21), einem Regulator der Energiekosten [ 57 , 58 ]. HRW hat neuroprotektive Eigenschaften in einem murinen MTTP-induzierten PD-Modell gezeigt [ 45 , 59 , 60]. Lin und Kollegen berichteten, dass HRW das OS bei Patienten mit chronischer Hepatitis B und metabolischem Syndrom reduziert [ 61 ].
Studien haben gezeigt, dass H 2 Vorteile haben kann, indem es den Nrf2-Signalweg aktiviert, wodurch die antioxidative Aktivität verbessert und OS, Apoptose und Entzündungen reduziert werden [ 46 , 62 ]. H 2 erhöht die antioxidative Aktivität von Enzymen bei Strahlung und TBI durch die Hochregulierung von Nrf2 [ 63 ]. Der grundlegende entzündungshemmende Mechanismus von H 2 kann über den Nrf2-Signalweg sogar von Makrophagen genutzt werden [ 64 ]. Nrf2 ist ein Transkriptionsfaktor, der antioxidative Reaktionselemente kombiniert, um die Expression von Antioxidantien zu steuern und den Körper vor Verletzungen und Entzündungen sowie oxidativen Schäden zu schützen [ 65 ].
5. Entzündungshemmende Wirkung von H 2 in neurodegenerativen Krankheitsmodellen
Zahlreiche Studien haben über die entzündungshemmende Wirkung von H 2 berichtet [ 63 , 64 , 66 ]. Zu den Vorteilen zählen die schnelle Ausbreitung, die hohe Penetrationsfähigkeit und das Fehlen deutlicher Nebenwirkungen. H 2 fängt ROS-Radikale ab und ist äußerst wirksam bei der Reduzierung von Entzündungen in zahlreichen Geweben und Organen, einschließlich Herz, Gehirn und Lunge, und gilt als Abwehrmittel gegen oxidative Schäden [ 67 , 68 ]. HRW wurde umfassend auf seine Fähigkeit untersucht, Entzündungsreaktionen zu hemmen und neuronale Apoptose zu lindern [ 18 , 69] . ]. Mikroglia verursacht wahrscheinlich eine Neuroinflammation im Gehirn. Aktivierte Mikroglia und ROS produzieren proinflammatorische Zytokine. Eine der Studien zeigte, dass H 2 in In-vitro- und In-vivo-Modellen eine vielversprechende Wirkung auf die Prävention und Entzündung im Zusammenhang mit perinatalen Hirnverletzungen hat [ 70 ]. Darüber hinaus wurde in derselben Studie berichtet, dass HW die durch Lipopolysaccharid (LPS) induzierte Produktion von ROS durch Mikroglia verhindert und die LPS-induzierte mikrogliale Neurotoxizität verringert [ 70 ]. Mehrere Studien haben gezeigt, dass HS Darminfektionen wie intestinale IR-Schäden, Colitis ulcerosa und Dickdarmentzündungen lindern kann [ 71 , 72] . ]. Darüber hinaus hat HRW eine vorbeugende Wirkung gegen die Bildung von Superoxidionen bei SMP30/GNL-Knockout-Mäusen mit Vitamin C-Mangel unter Hypoxie-Reoxygenierungsbedingungen gezeigt [ 73 ]. Darüber hinaus wurde in einer der Studien berichtet, dass die Zugabe von H 2 zu Hämodialyselösungen eine entzündungshemmende und blutdrucksenkende Wirkung gegen Hämodialysepatienten hatte, was darauf hindeutet, dass dies eine therapeutische Option für Urämiepatienten ist [ 74 ]. In einer anderen Studie wurde die Rolle des Muskelabbaus bei Sportlern durch die Verwendung von H 2 bei intensiver körperlicher Betätigung verstärkt [ 21] . ]. Domoki und Kollegen berichteten, dass eine durch Wasserstoff verstärkte Luftbeatmung um 2,1 % die zerebrovaskuläre Reaktivität gegenüber Hyperkapnie im Wesentlichen aufrechterhielt und die durch Asphyxie-Reventilation verursachte neuronale Schädigung in einem perinatalen Asphyxie-Neugeborenen-Schweinemodell verringerte [ 75 ] . Darüber hinaus verhinderte HRW endoplasmatischen Stress und erhöhte die HO-1-Expression [ 64 ]. HRW verbessert auch die kognitive Beeinträchtigung bei Mäusen mit beschleunigter Seneszenz [ 53 ].
6. Auswirkungen von molekularem Wasserstoff auf Tier- und Menschen bei neurodegenerativer Erkrankungen
PD wird durch den Tod dopaminerger Neuronen am SNpc des Mittelhirns verursacht und ist nach AD die zweithäufigste ND. PD wird durch zwei Mechanismen verursacht: übermäßiges OS und das abnormale Ubiquitin-Proteasom-System [ 17 , 76 ]. Dopamin selbst ist ein Prooxidans und dopaminerge Zellen sind darauf ausgelegt, hohen Mengen an ROS ausgesetzt zu sein. Im neuronalen Zellkörper führt ein unregelmäßiges Ubiquitin-Proteasom-System häufig zur Ansammlung von unlöslichem α-Synuclein, was zum Absterben neuronaler Zellen führt. Durch stereotaktische Injektion des katecholaminergen Neurotoxins 6-Hydroxydopamin in das rechte Striatum erstellte eine Forschungsgruppe ein Ratten-Hemi-PD-Modell, und es wurde gezeigt, dass H 2 einen positiven Einfluss hat [ 77]. Eine andere Studie zeigte eine ähnlich ausgeprägte Wirkung von HRW auf ein MPTP-induziertes Mausmodell der Parkinson-Krankheit [ 76 ]. Es ist interessant festzustellen, dass die für MPTP-Mäuse verwendeten H 2 -Werte nur 5 % betrugen, der zweitniedrigste aller bisher veröffentlichten Studien an Nagetieren oder Menschen.
AD ist die häufigste ND und zeichnet sich durch eine unregelmäßige Ansammlung von β-Amyloid (Aβ) und Tau mit großen Aggregaten aus, die als senile Plaques und neurofibrilläre Knäuel bekannt sind [ 78 ]. Verschiedene Untersuchungen haben die Wirkung von H 2 in verschiedenen AD-Tiermodellen nachgewiesen [ 17 , 33 , 46 ]. Eine Forschungsgruppe berichtete, dass die Verabreichung von HW kognitive Beeinträchtigungen verhinderte und das OS hemmte [ 33 ]. Gleichzeitig beobachteten sie, dass HW die neurale Proliferation des Gyrus dentatus nach Zurückhaltungsstress wiederherstellte [ 33 ]. Li und Kollegen entwickelten ein Rattenmodell mit intrazerebroventrikulärer Injektion von Aβ (1–42) AD [ 79]. Bei der HS-Behandlung stellten sie fest, dass verringerte Lern- und Gedächtnisstörungen sowie verringertes Aβ eine Nervenentzündung verursachten [ 79 ]. HS unterdrückte auch die Lipidperoxidation und Entzündungsmediatoren wie IL-6 und TNF-α [ 79 ]. Darüber hinaus berichteten Wang und Kollegen, dass die Schutzwirkung von HS möglicherweise auf die Aktivierung der c-Jun-N-terminalen Kinase (JNK)- und Kernfaktor-κB-(NF-κB)-Wege zurückzuführen ist [ 80 ] . Darüber hinaus ergab eine Studie an einem Demenz-Mausmodell, dass die Verabreichung von HW das OS verringerte und den Rückgang des Gedächtnisses und der Kognition verhinderte, während gleichzeitig die Lebensdauer der Mäuse verlängert wurde. Ein Ergebnis einer klinischen Studie zeigte, dass H 2 die Kognition bei Trägern des Apolipoprotein-E4-Genotyps deutlich verbessern kann [ 53]. Studien haben den Zusammenhang von Apolipoprotein E mit entzündungshemmenden, antiapoptotischen und antioxidativen Wirkungen bei Hirnverletzungen gezeigt [ 81 ]. In Tabelle 1 sind die Auswirkungen von H 2 auf NDs wie Parkinson, AD und andere Gehirnerkrankungen aufgeführt.

7. Wasserstofftherapie bei neonatalen Hirnerkrankungen
Hirnstörungen sind die Schlüsselfaktoren für die Entwicklung von Autismus, Zerebralparese, geistiger Verzögerung und verschiedenen anderen Beeinträchtigungen [ 99 ]. Perinatale Asphyxie ist eine der Hauptursachen für Hirnschäden bei Neugeborenen [ 99 ]. Entzündungen und OS sind Hauptursachen für neuronale Apoptose-Hypoxie-Ischämie [ 100 ]. Cai und Kollegen haben über die Verringerung der neuronalen Apoptose aufgrund neonataler Hypoxie bei Ratten durch H 2 -Gas-Inhalation berichtet [ 101 ]. In einer Studie wurde das abnormale Verhalten bei Ratten 5 Wochen nach Hypoxie-Ischämie durch HS-Verabreichung verbessert [ 102 ]. H 2 Gas reduzierte neuronale Schäden, die durch die Großhirnrinde, den Hippocampus, die Basalganglien und die Hypoxie-Ischämie-Gehirnventilation bei neugeborenen Schweinen verursacht wurden [ 75 ]. Eine Studie zeigte, dass die Inhalation von H 2 -Gas die Zeit nach dem Ersticken bei neugeborenen Schweinen von 4 Stunden auf 24 Stunden verlängerte, was das H 2 -Gastranslationspotenzial unterstreicht [ 103 ]. Es wurde festgestellt, dass die Verabreichung von H 2 an Neugeborene mit ischämischer Hirnverletzung bei der prognostischen Verbesserung hochwirksam sein. Mano und Kollegen berichteten auch über die Verbesserung der durch IRI verursachten Schäden am Hippocampus durch die mütterliche HRW-Verabreichung von 4-Hydroxy-Xynonenal und 8-OHdG am Tag 7 nach der Geburt [ 25 ]. Darüber hinaus berichtete eine andere Studie, dass H 2 verbesserte fetale Hirnschädigung bei Mäusen, die durch die Exposition der Mutter gegenüber LPS verursacht wurde [ 70 ]. Die Verabreichung von H 2 in verschiedenen Formen wie HRW, HS oder Wasserstoffinhalation zeigt entzündungshemmende und antioxidative Wirkungen, wie in vielen Studien beobachtet wurde [ 33 , 79 , 80 , 84 ]. H 2 kann auch den Energiestoffwechsel anregen, um neuronale Schäden zu reduzieren. Beispielsweise könnte es die Expression von FGF21 hochregulieren [ 104 ]. Diese Ergebnisse deuten darauf hin, dass die pränatale H2 - Verabreichung ein wirksamer Ansatz zur Behandlung des entzündlichen fetalen Reaktionssyndroms sein könnte [ 104 ]. Eine Studie zeigte, dass die Exposition gegenüber Sevofluran bei Mäusen abnormales Sozialverhalten, ähnlich wie Autismus, hervorruft [ 105 ]. Damit berichteten Yonamine und Kollegen, dass die H2 - Gasbehandlung das durch Sevofluran verursachte erhöhte OS bei neugeborenen Mäusen beseitigt [ 106 ]. Darüber hinaus verhinderte die gleichzeitige Gabe von H2 ein abnormales mütterliches Verhalten später im Erwachsenenalter, das aus der Exposition des Neugeborenen gegenüber Sevofluran resultierte, was auf ein erhebliches H2-Gaspotenzial bei der Reduzierung nachteiliger Auswirkungen der Anästhesieexposition hinweist [ 106 , 107 ] .
8. Mechanismen der Wasserstoffbehandlung bei neurodegenerativen Erkrankungen
Das Verständnis der Wirkmechanismen von H 2 bei NDs ist wichtig, um den Einsatz von H 2 in der klinischen Therapie vollständig zu erforschen. OS und Entzündung tragen hauptsächlich zur Pathogenese von AD, PD und anderen neurodegenerativen Erkrankungen bei. AD ist die häufigste ND, die Demenz verursacht [ 10 , 17 , 78 ]. In den meisten Fällen leiden AD-Patienten unter vermindertem Lernen und Gedächtnis, kognitiven Beeinträchtigungen sowie sozialen und emotionalen Störungen [ 3 , 108] .]. Auch mitochondriale Schäden werden durch Tau-Protein verursacht, was zu Energiestörungen, ROS-Produktion und letztendlich zu Schäden an synaptischen Eigenschaften führt. Tau-Protein verursacht auch mitochondriale Schäden, was zu Energiestörungen, ROS-Produktion und letztendlich zu Schäden an synaptischen Eigenschaften führt. Die Überproduktion von Aβ im Gehirn führt zu einer Funktionsstörung mitochondrialer Komplexe, die zur Überproduktion von ROS und zum Abbau von Adenosintriphosphat (ATP) beitragen [ 80 , 108 , 109] .]. ATP ist wichtig für den axonalen Transport und die Neurotransmission und trägt zur Aufrechterhaltung der Ionenkanalfunktion und des Ionengleichgewichts sowohl intern als auch extern in Zellen bei. Der ATP-Mangel ist daher die Ursache für mitochondriale Schäden. Darüber hinaus führt ein Anstieg der ROS zu einer Verschiebung der Pole der Mitochondrienpore, was dazu führt, dass Kalziumionen in die Mitochondrien fließen, was die Mitochondrienschädigung verschlimmert [ 109 ]. ROS können auch die Membranfunktion beeinträchtigen, was zur Lipidperoxidation führt, die Apoptose in Zellen fördert und die Anzahl der Neuronen verringert. Kurz gesagt, zu den pathogenen mechanistischen Systemen von AD gehören bekanntermaßen cholinerge Funktionsstörung, Amyloidkaskade, OS, Entzündung, Exzitotoxizität und Steroidhormonmangel [ 110]. In NDs sind proinflammatorische Zytokine wie NF-κB, IL-1β, IL-6, IL-10, TNF-α, CC-Motiv-Chemokinligand 2 (CCL-2), Interferon-γ und interzelluläre Adhäsionsmoleküle enthalten. 1, sind an der entzündungshemmenden Wirkung von H 2 beteiligt [ 15 , 26 , 43 ]. Die Abnahme der Kernbindungsdomäne Leucin-reiche Wiederholung und Pyrindomäne enthaltendes Protein-3 (NLRP3) in AD-transgenen Mausmodellen hat Es wurde gezeigt, dass es Gedächtnisstörungen und Aβ-Ablagerungen hemmt [ 111 ]. Eine Studie von Ren und Kollegen zeigte, dass H 2 die Entzündungsaktivierung von NLRP3 in AD-Gehirnen hemmt [ 112 ].
Darüber hinaus berichteten Lin und Kollegen, dass HRW die AMP-aktivierte Proteinkinase (AMPK) steigern kann. Sirt1-FoxO3a-Signalwege können eine Rolle bei antioxidativem Stress spielen, mitochondriale Schäden reduzieren, als neuroprotektives Mittel wirken und durch AD verursachte ROS neutralisieren [ 113 ]. Sirt1 kann auch Autophagie induzieren, die bei vielen NDs eine neuronale Rolle spielt [ 114 ]. Autophagie ist ein wesentlicher Prozess zur Aufrechterhaltung der Zellhomöostase und durch die Förderung der Autophagie bei AD [ 114 ] kann H 2 auch Zellen schützen. Phospho-p38 und JNK sind als Mitglieder der Mitogen-aktivierten Proteinkinase (MAPK) an der Kontrolle des Zellüberlebens beteiligt [ 15 , 80]. Henderson und Kollegen berichteten über eine verbesserte Bax-Phosphorylierung der AD-Gehirne und eine mitochondriale Translokation, die durch OS und p38K verursacht wurde [ 115 ]. Die Ergebnisse in vielen Tiermodellen haben gezeigt, dass H 2 -Wasser die Aktivierung von Phospho-p38 und JNK stoppen kann [ 15 , 80 , 116 ].
Interessanterweise berichteten Hou und Kollegen, dass HRW die kognitive Funktion bei weiblichen AD-Mäusen verbessert, indem es den Östrogenspiegel im Gehirn, ERβ und die Expression des neurotrophen Faktors (BDNF) im Gehirn reduziert, bei Männern jedoch nicht und ohne die Behandlung mit dem β-Amyloid-Vorläuferprotein zu beeinflussen und Aβ-Clearance [ 117 ]. Darüber hinaus waren Entzündung und OS bei weiblichen AD-Mäusen stärker ausgeprägt als bei männlichen. Dies legt nahe, dass Wasserstoff auch an der Pathogenese von AD beteiligt sein kann, indem er den ERβ-BDNF-Östrogen-Signalweg beeinflusst [ 117 ]. MAPK und der Signalweg der Proteinkinase C können AD und neuronale Schäden hemmen [ 70]. Es wurde auch angenommen, dass BDNF und Tyrosinkinase-Empfänger B dazu bestimmt waren, die Expression neuronal verwandter Gene zu regulieren. Schließlich werden die synaptische Plastizität, das Lernen und die Erinnerungsfähigkeit durch die H2-Behandlung verbessert [ 70 ] . Darüber hinaus stand der Östrogen-ERβ-BDNF-Signalweg mit den antioxidativen und entzündungshemmenden Wirkungen bei AD in Zusammenhang [ 118 ]. Bei der pathologischen AD-Prävention beinhaltet die Aktivierung des ERβ-Signals auch das Auffangen von ROS [ 118 ]. Zu den Hauptwirkungsmechanismen von H 2 gehören daher entzündungshemmende, antioxidative und antiapoptotische Eigenschaften sowie die Regulierung der Autophagie und des Hormonsignalwegs [ 15 ].
9. Studien zur Wasserstofftherapie bei neurodegenerativen Erkrankungen
Das Verständnis der Wirkmechanismen von H 2 bei NDs ist wichtig, um den Einsatz von H 2 in der klinischen Therapie vollständig zu erforschen. OS und Entzündung tragen hauptsächlich zur Pathogenese von AD, PD und anderen neurodegenerativen Erkrankungen bei. AD ist die häufigste ND, die Demenz verursacht [ 10 , 17 , 78 ]. In den meisten Fällen leiden AD-Patienten unter vermindertem Lernen und Gedächtnis, kognitiven Beeinträchtigungen sowie sozialen und emotionalen Störungen [ 3 , 108] .]. Auch mitochondriale Schäden werden durch Tau-Protein verursacht, was zu Energiestörungen, ROS-Produktion und letztendlich zu Schäden an synaptischen Eigenschaften führt. Tau-Protein verursacht auch mitochondriale Schäden, was zu Energiestörungen, ROS-Produktion und letztendlich zu Schäden an synaptischen Eigenschaften führt. Die Überproduktion von Aβ im Gehirn führt zu einer Funktionsstörung mitochondrialer Komplexe, die zur Überproduktion von ROS und zum Abbau von Adenosintriphosphat (ATP) beitragen [ 80 , 108 , 109] .]. ATP ist wichtig für den axonalen Transport und die Neurotransmission und trägt zur Aufrechterhaltung der Ionenkanalfunktion und des Ionengleichgewichts sowohl intern als auch extern in Zellen bei. Der ATP-Mangel ist daher die Ursache für mitochondriale Schäden. Darüber hinaus führt ein Anstieg der ROS zu einer Verschiebung der Pole der Mitochondrienpore, was dazu führt, dass Kalziumionen in die Mitochondrien fließen, was die Mitochondrienschädigung verschlimmert [ 109 ]. ROS können auch die Membranfunktion beeinträchtigen, was zur Lipidperoxidation führt, die Apoptose in Zellen fördert und die Anzahl der Neuronen verringert. Kurz gesagt, zu den pathogenen mechanistischen Systemen von AD gehören bekanntermaßen cholinerge Funktionsstörung, Amyloidkaskade, OS, Entzündung, Exzitotoxizität und Steroidhormonmangel [ 110]. In NDs sind proinflammatorische Zytokine wie NF-κB, IL-1β, IL-6, IL-10, TNF-α, CC-Motiv-Chemokinligand 2 (CCL-2), Interferon-γ und interzelluläre Adhäsionsmoleküle enthalten. 1, sind an der entzündungshemmenden Wirkung von H 2 beteiligt [ 15 , 26 , 43 ]. Die Abnahme der Kernbindungsdomäne Leucin-reiche Wiederholung und Pyrindomäne enthaltendes Protein-3 (NLRP3) in AD-transgenen Mausmodellen hat Es wurde gezeigt, dass es Gedächtnisstörungen und Aβ-Ablagerungen hemmt [ 111 ]. Eine Studie von Ren und Kollegen zeigte, dass H 2 die Entzündungsaktivierung von NLRP3 in AD-Gehirnen hemmt [ 112 ].
Darüber hinaus berichteten Lin und Kollegen, dass HRW die AMP-aktivierte Proteinkinase (AMPK) steigern kann. Sirt1-FoxO3a-Signalwege können eine Rolle bei antioxidativem Stress spielen, mitochondriale Schäden reduzieren, als neuroprotektives Mittel wirken und durch AD verursachte ROS neutralisieren [ 113 ]. Sirt1 kann auch Autophagie induzieren, die bei vielen NDs eine neuronale Rolle spielt [ 114 ]. Autophagie ist ein wesentlicher Prozess zur Aufrechterhaltung der Zellhomöostase und durch die Förderung der Autophagie bei AD [ 114 ] kann H 2 auch Zellen schützen. Phospho-p38 und JNK sind als Mitglieder der Mitogen-aktivierten Proteinkinase (MAPK) an der Kontrolle des Zellüberlebens beteiligt [ 15 , 80]. Henderson und Kollegen berichteten über eine verbesserte Bax-Phosphorylierung der AD-Gehirne und eine mitochondriale Translokation, die durch OS und p38K verursacht wurde [ 115 ]. Die Ergebnisse in vielen Tiermodellen haben gezeigt, dass H 2 -Wasser die Aktivierung von Phospho-p38 und JNK stoppen kann [ 15 , 80 , 116 ].
Interessanterweise berichteten Hou und Kollegen, dass HRW die kognitive Funktion bei weiblichen AD-Mäusen verbessert, indem es den Östrogenspiegel im Gehirn, ERβ und die Expression des neurotrophen Faktors (BDNF) im Gehirn reduziert, bei Männern jedoch nicht und ohne die Behandlung mit dem β-Amyloid-Vorläuferprotein zu beeinflussen und Aβ-Clearance [ 117 ]. Darüber hinaus waren Entzündung und OS bei weiblichen AD-Mäusen stärker ausgeprägt als bei männlichen. Dies legt nahe, dass Wasserstoff auch an der Pathogenese von AD beteiligt sein kann, indem er den ERβ-BDNF-Östrogen-Signalweg beeinflusst [ 117 ]. MAPK und der Signalweg der Proteinkinase C können AD und neuronale Schäden hemmen [ 70]. Es wurde auch angenommen, dass BDNF und Tyrosinkinase-Empfänger B dazu bestimmt waren, die Expression neuronal verwandter Gene zu regulieren. Schließlich werden die synaptische Plastizität, das Lernen und die Erinnerungsfähigkeit durch die H2-Behandlung verbessert [ 70 ] . Darüber hinaus stand der Östrogen-ERβ-BDNF-Signalweg mit den antioxidativen und entzündungshemmenden Wirkungen bei AD in Zusammenhang [ 118 ]. Bei der pathologischen AD-Prävention beinhaltet die Aktivierung des ERβ-Signals auch das Auffangen von ROS [ 118 ]. Zu den Hauptwirkungsmechanismen von H 2 gehören daher entzündungshemmende, antioxidative und antiapoptotische Eigenschaften sowie die Regulierung der Autophagie und des Hormonsignalwegs [ 15 ].

10. Andere neurologische Störungen
Zahlreiche Studien haben ein häufiges Auftreten von ZNS-Störungen, einschließlich Netzhautischämie, gezeigt [ 82 , 88 , 121 ]. Während Ischämieperioden wurden regelmäßig topische HS-Augentropfen verabreicht, und es wurde festgestellt, dass die Tropfen einen Anstieg von •OH unterdrücken. Darüber hinaus reduziert HS die Anzahl apoptotischer und oxidativer Zellen mit Netzhautstress und verhindert eine Netzhautverdünnung mit der damit verbundenen Aktivierung von Müller-Glia, Astrozyten und Mikroglia [ 122 ]. Darüber hinaus wurde berichtet, dass H 2 sich in Hörgewebekulturen vor Antimycin A und einem Cisplatin verursachenden Stamm schützte, was darauf hindeutet, dass H 2 die Zerstörung von Haarzellen verhinderte, teilweise durch Reduzierung der ROS-Produktion [ 123, 124 , 125 ]. Wenn das Ohr lauten Geräuschen ausgesetzt ist, führt die Überstimulation der Haarzellen zur Entwicklung von ROS, die zum Zelltod führt [ 90 , 123 ]. Kürzlich wurde gezeigt, dass die intraperitoneale HS-Injektion Meerschweinchen vor lärmbedingtem Hörverlust schützt [ 125 ].
Darüber hinaus verursachen Schädel-Hirn-Trauma und Rückenmarksverletzungen in Entwicklungsländern die meisten Todesfälle und Behinderungen. In verschiedenen Regionen gibt es schätzungsweise 200–600 Verletzungen pro 100.000 Menschen aufgrund von ZNS-Verletzungen [ 126 ]. Ji und Kollegen berichteten, dass die Verabreichung von H 2 das TBI-Tiermodell vor dem neuronalen Zelltod schützte [ 127 ]. Das Einatmen von H2 - Gas verhindert das Wachstum oxidativer Produkte und verbessert die Enzymaktivität endogener Antioxidantien (SOD und CAT) im Gehirngewebe, was zu einem Ratten-TBI-Modell führt [ 127 ]. Darüber hinaus haben Dohi und Kollegen berichtet, dass die Verwendung von HRW das TBI-Ödem hemmte und die Expression von pathologischem Tau bei Mäusen vollständig blockierte [ 128 ]. Darüber hinaus hat HZwei Behandlungen wurden auch eingesetzt, um Sepsis und LPS-Entzündungen im Gehirn zu verhindern und Kohlenmonoxid-Nagetiere vor Toxizität zu schützen [ 52 , 129 ].
11. Therapeutische Wirksamkeit des H 2 -Moleküls
H 2 hat umfassende und zahlreiche Auswirkungen auf NDs, einschließlich PD. Darüber hinaus wurden aufgrund seiner vorteilhaften Wirksamkeit bisher keine nachteiligen Auswirkungen gemeldet. Das Gehirn kann durch die Inhalation von H 2 -Gas sowie durch HS-Injektion mit nachweisbaren H 2 -Mengen versorgt werden [ 28 ]. Andererseits ist die H 2 -Konzentration nach HRW-Verabreichung zu niedrig, um mit einem herkömmlichen Wasserstoffsensor erfasst zu werden. Interessanterweise hat HRW in einem Tier-PD-Modell bessere Ergebnisse als H2-Gas gezeigt [ 18 ] . Matsumoto und Kollegen berichteten, dass HRW die Magenexpression und die Ghrelin-Sekretion in Mausmodellen steigerte [ 130] .]. Interessanterweise wurde die neurologische Wirkung von HRW durch einen Wachstumshormon-Sekretagogen-Rezeptor (GHSR) (Ghrelin-Rezeptor-Antagonist) und einen Ghrelin-Sekretions-Antagonisten zunichte gemacht [ 130 ]. Es wurde festgestellt, dass Ghrelin die Freisetzung von Wachstumshormonen und die Nahrungsaufnahme fördert, und GHSRs manifestieren sich in dopaminergen Neuronen der Substantia nigra. Ghrelin wirkt bei Parkinson neuroprotektiv, da es Mikroglia-bedingte Neuroinflammationen hemmt [ 131 ]. Basierend auf diesen Ergebnissen wird erwartet, dass höhere H2-Spiegel im HRW einen direkten Einfluss auf die Magenzellen haben, die Ghrelin produzieren, und die intrazelluläre Signalsekretion von Ghrelin regulieren [ 130 ].
Darüber hinaus hat eine der Studien gezeigt, dass HO-1 und seine Enzymprodukte mit ischämischen Hirnschäden verbunden sind. Eine ähnliche Studie zeigte jedoch, dass die Inhalation von H2 - Gas die Lungenhyperoxie bei Nrf2-Knockout-Mäusen nicht verbessert und dass die Inhalation während der Hyperoxie von Kawamura und Kollegen nicht die Sauerstoffversorgung des Blutes erhöht, Entzündungen reduziert und die Expression von HO-1 induziert in der Lunge [ 132 ]. HO-1 ist an der Produktion von Kohlenmonoxid, freien Ionen und Biliverdin im enzymatischen Häm beteiligt und wird bei der Transkription durch Nrf2 überwacht. Daher ist HO-1 an der Abwehr von Zellen gegen OS beteiligt, und es wurde die Hypothese aufgestellt, dass HO-1 ein neuroprotektives therapeutisches Ziel sein könnte. HO-1-Mutationen wurden mit einem hohen Risiko der Auslösung der HO-1-Expression in Verbindung gebracht [53 , 55 , 132 ].
Darüber hinaus haben Iuchi und Kollegen gezeigt, dass H 2 selbst in geringeren Konzentrationen (ungefähr 1 % v/v ) die Ca 2+ -Signale moduliert und die Genexpression reguliert, indem es die Produktion oxidierter Phospholipide verändert [ 133 ]. Da H 2 das kleinste und unpolare Molekül ist, ist es unwahrscheinlich, dass einige Proteinmediatoren binden. Weitere Forschung ist erforderlich, um das direkte Zielmolekül von H 2 zu identifizieren . H 2 reguliert die Zellreaktion auf OS, Entzündung und Apoptose [ 27 ].
Menschen sind harmlos, wenn sie Wasserstoff ausgesetzt sind. Das Explosionsrisiko bei Konzentrationen über 4 % ist ein limitierender Faktor bei der Verwendung von H 2 -Gasstudien. Sicherere Speichertechnologien, insbesondere Hydride, werden entwickelt [ 27 , 134 ]. Die Explosionsgefahr kann auch durch die Lösung von H 2 in Wasser oder normaler Kochsalzlösung, entweder oral oder intravenös, beseitigt werden [ 134 ].
12. Neue Vorteile des H 2 -Moleküls
Bisher liegen keine ausreichenden Informationen über die Pharmakodynamik und Toxizität von H 2 vor . Die therapeutische Wirkung von H 2 ist im medizinischen Bereich bereits anerkannt. Bevor es jedoch als harmloses und wirksames Heilgas anerkannt wird, müssen zahlreiche Probleme gelöst werden [ 27 , 135 ]. Als wertvolles Behandlungsmittel in der klinischen Medizin bietet H 2 zahlreiche potenzielle Vorteile. Seine physikalischen Eigenschaften und eine niedrige Molekularmasse ermöglichen eine schnelle Verteilung im Zytosol, anderen Zielzellen und den subzellulären Kompartimenten durch die Plasmamembran [ 14 , 15 , 27 ]. H 2Die Geburt hat keinen Einfluss auf physiologische Parameter wie Sauerstoffsättigung, Temperatur, pH-Wert und Blutdruck [ 27 , 31 ].
In den biomedizinischen Wissenschaften scheinen die Auswirkungen von H 2 denen anderer Arten von therapeutischen Gasfamilien wie Stickoxid, Schwefelwasserstoff und Kohlenmonoxid zu ähneln. Noch vor 10 Jahren wurde H 2 ernsthaft als unreaktives Gas in Betracht gezogen; Wissenschaftler sehen H 2 nun als Heilmittel und eine bevorzugte Behandlungsmethode [ 136 ]. Obwohl die vorhandenen Informationen zu H 2 nach wie vor unzureichend sind, sind die vielversprechenden Eigenschaften der H 2 -Therapie, die in einigen Pilotstudien festgestellt wurden, die Motivation für zukünftige Forschung. Die Wertschätzung der Aktivitäten von H 2 könnte uns zu neuen Formen der H 2- Therapie für viele Leiden und Krankheiten des Menschen führen.
13. Schlussbemerkungen
Obwohl mehrere NDs derzeit unheilbar sind, wird durch zahlreiche Studien auf die therapeutische potenzielle Wirkung der H 2 -Verabreichung zur Vorbeugung, Behandlung und Linderung dieser Erkrankungen hingewiesen. Obwohl einige NDs derzeit nicht heilbar sind, weisen mehrere Studien auf eine therapeutische Wirkung hin. Potenzial der H2-Verabreichung zur Vorbeugung, Behandlung und Linderung bestimmter Erkrankungen. Bisher liegen keine Berichte über schädliche Wirkungen von H 2 vor. H 2 ist im Gesundheitsalltag relativ einfach umzusetzen, kostengünstig und effizient. Der optimale Weg und die optimale Dosis der H2-Verabreichung für jede Krankheit müssen jedoch noch ermittelt werden. Diese Übersicht fasst aktuelle Erkenntnisse zur präventiven und therapeutischen Rolle von H 2 zusammen in verschiedenen Tiermodellen und den menschlichen Pathologien von OS-bedingten NDs, Entzündungen und Apoptose. Weitere Studien sind erforderlich, um die grundlegenden Konzepte und das Verständnis von H 2 für seinen optimalen klinischen Einsatz zu erweitern.
OH Hydroxyl radical
AD Azheimer’s disease
AMPK AMP-activated protein kinase
ATP Adenosine triphosphate
Aβ Amyloid beta
BDNF Brain-derived neurotrophic factor
CAT Catalase
CCL-2 C-C motif chemokine ligand 2
CNS Central nervous system
FGF21 Fibroblast growth factor 21
FIRS Inflammatory fetal response syndrome
GHSR Growth hormone secretagogue receptor
GPx Glutathione peroxidase
HD Hemodialysis
HO-1 Heme oxygenase-1
HRW Hydrogen-rich water
HS Hydrogen dissolved saline
HW H2-dissolved water (or H2-water)
IL InterleukinIRIschemia-reperfusion
IRI Ischemia-reperfusion injury
JNK c-Jun N-terminal Kinase
LPS Lipopolysaccharide
LTP Long-term potentiation
MAPK Mitogen-activated protein kinase
MTTP 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine
NDNeurodegenerative disease
NF-κB Nuclear factor κB
NLRP3 NLR Family Pyrin Domain Containing 3
Nrf2 Nuclear factor-E2-related factor 2
ONO O-Peroxynitrite
OS Oxidative stress
PD Parkinson’s disease
ROS Reactive oxygen species
SNpc Substantia nigra pars compacta
SOD Superoxide dismutase
TBI Traumatic brain injury
TNF-α Tumor necrosis factor-α
References
- Tarozzi, A. Oxidative stress in neurodegenerative diseases: From preclinical studies to clinical applications. J. Clin. Med. 2020, 9, 1223. [Google Scholar] [CrossRef] [PubMed]
- Hannan, M.A.; Dash, R.; Sohag, A.A.M.; Haque, M.; Moon, I.S. Neuroprotection against oxidative stress: Phytochemicals targeting TrkB signaling and the Nrf2-ARE antioxidant system. Front. Mol. Neurosci. 2020, 13, 116. [Google Scholar] [CrossRef]
- Singh, E.; Devasahayam, G. Neurodegeneration by oxidative stress: A review on prospective use of small molecules for neuroprotection. Mol. Biol. Rep. 2020, 1–8. [Google Scholar] [CrossRef]
- Yeung, A.W.; Tzvetkov, N.T.; Georgieva, M.G.; Ognyanov, I.V.; Kordos, K.; Jóźwik, A.; Kühl, T.; Perry, G.; Petralia, M.C.; Mazzon, E.; et al. Reactive oxygen species and their impact in neurodegenerative diseases: Literature landscape analysis. Antioxid. Redox Signal. 2021, 34, 402–420. [Google Scholar] [CrossRef] [PubMed]
- Schieber, M.; Chandel, N.S. ROS function in redox signaling and oxidative stress. Curr. Biol. 2014, 24, R453–R462. [Google Scholar] [CrossRef][Green Version]
- Lee, K.H.; Cha, M.; Lee, B.H. Neuroprotective effect of antioxidants in the brain. Int. J. Mol. Sci. 2020, 21, 7152. [Google Scholar] [CrossRef] [PubMed]
- Guan, Y.; Hickey, M.J.; Borgstahl, G.E.; Hallewell, R.A.; Lepock, J.R.; O’Connor, D.; Hsieh, Y.; Nick, H.S.; Silverman, D.N.; Tainer, J.A. Crystal structure of Y34F mutant human mitochondrial manganese superoxide dismutase and the functional role of tyrosine 34. Biochemistry 1998, 37, 4722–4730. [Google Scholar] [CrossRef]
- Bošković, M.; Grabnar, I.; Terzič, T.; Plesničar, B.K.; Vovk, T. Oxidative stress in schizophrenia patients treated with long-acting haloperidol decanoate. Psychiatry.Res. 2013, 210, 761–768. [Google Scholar] [CrossRef]
- Ambani, L.M.; Van Woert, M.H.; Murphy, S. Brain peroxidase and catalase in Parkinson Disease. Arch. Neurol. 1975, 32, 114–118. [Google Scholar] [CrossRef]
- Niedzielska, E.; Smaga, I.; Gawlik, M.; Moniczewski, A.; Stankowicz, P.; Pera, J.; Filip, M. Oxidative stress in neurodegenerative diseases. Mol. Neurobiol. 2016, 53, 4094–4125. [Google Scholar] [CrossRef][Green Version]
- Terlecky, S.R.; Koepke, J.I.; Walton, P.A. Peroxisomes and aging. Biochim. Biophy. Acta 2006, 1763, 1749–1754. [Google Scholar] [CrossRef][Green Version]
- Begum, R.; Kim, C.S.; Fadriquela, A.; Bajgai, J.; Jing, X.; Kim, D.H.; Kim, S.K.; Lee, K.J. Molecular hydrogen protects against oxidative stress-induced RAW 264.7 macrophage cells through the activation of Nrf2 and inhibition of MAPK signaling pathway. Mol. Cell Toxicol. 2020, 16, 103–118. [Google Scholar] [CrossRef]
- Ohsawa, I.; Ishikawa, M.; Takahashi, K.; Watanabe, M.; Nishimaki, K.; Yamagata, K.; Katsura, K.I.; Katayama, Y.; Asoh, S.; Ohta, S. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals. Nat. Med. 2007, 13, 688–694. [Google Scholar] [CrossRef]
- Ohta, S. Molecular hydrogen is a novel antioxidant to efficiently reduce oxidative stress with potential for the improvement of mitochondrial diseases. Biochim. Biophys. Acta 2012, 1820, 586–594. [Google Scholar] [CrossRef]
- Ge, L.; Yang, M.; Yang, N.N.; Yin, X.X.; Song, W.G. Molecular hydrogen: A preventive and therapeutic medical gas for various diseases. Oncotarget 2017, 8, 102653–102673. [Google Scholar] [CrossRef][Green Version]
- Noda, M.; Fujita, K.; Hamner, M.A.; Yamafuji, M.; Akimoto, N.; Kido, M.A.; Tanaka, Y.; Nakabeppu, Y.; Ransom, B.R. Molecular hydrogen protects against central nervous system white matter ischemic injury. In Proceedings of the SfN 42nd Annual Meeting, New Orleans, LA, USA, 13–17 October 2012; Volume 660, p. 14. [Google Scholar]
- Fujita, K.; Nakabeppu, Y.; Noda, M. Therapeutic effects of hydrogen in animal models of Parkinson’s disease. Parkinson Dis. 2011, 2011, 307875. [Google Scholar] [CrossRef][Green Version]
- Ito, M.; Hirayama, M.; Yamai, K.; Goto, S.; Ichihara, M.; Ohno, K.; Ito, M. Drinking hydrogen water and intermittent hydrogen gas exposure, but not lactulose or continuous hydrogen gas exposure, prevent 6-hydorxydopamine-induced Parkinson’s disease in rats. Med. Gas. Res. 2012, 2, 1–7. [Google Scholar] [CrossRef][Green Version]
- Nagatani, K.; Nawashiro, H.; Takeuchi, S.; Tomura, S.; Otani, N.; Osada, H.; Wada, K.; Katoh, H.; Tsuzuki, N.; Mori, K. Safety of intravenous administration of hydrogen-enriched fluid in patients with acute cerebral ischemia: Initial clinical studies. Med. Gas. Res. 2013, 3, 13. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Ono, H.; Nishijima, Y.; Ohta, S.; Sakamoto, M.; Kinone, K.; Horikosi, T.; Tamaki, M.; Takeshita, H.; Futatuki, T.; Ohishi, W.; et al. Hydrogen gas inhalation treatment in acute cerebral infarction: A randomized controlled clinical study on safety and neuroprotection. J. Stroke. Cerebrovasc. Dis. 2017, 26, 2587–2594. [Google Scholar] [CrossRef] [PubMed][Green Version]
- LeBaron, T.W.; Laher, I.; Kura, B.; Slezak, J. Hydrogen gas: From clinical medicine to an emerging ergogenic molecule for sports athletes. Can. J. Physiol. Pharmacol. 2019, 97, 797–807. [Google Scholar] [CrossRef] [PubMed]
- Nicolson, G.L.; de Mattos, G.F.; Settineri, R.; Costa, C.; Ellithorpe, R.; Rosenblatt, S.; Ohta, S. Clinical effects of hydrogen administration: From animal and human diseases to exercise medicine. Int. J. Clin. Med. 2016, 7, 32–76. [Google Scholar] [CrossRef][Green Version]
- Qin, L.; Liu, Y.; Wang, T.; Wei, S.J.; Block, M.L.; Wilson, B.; Liu, B.; Hong, J.S. NADPH oxidase mediates lipopolysaccharide-induced neurotoxicity and proinflammatory gene expression in activated microglia. J. Biol. Chem. 2004, 279, 1415–1421. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Spulber, S.; Edoff, K.; Hong, L.; Morisawa, S.; Shirahata, S.; Ceccatelli, S. Molecular hydrogen reduces LPS-induced neuroinflammation and promotes recovery from sickness behaviour in mice. PLoS ONE 2012, 7, e42078. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Mano, Y.; Kotani, T.; Ito, M.; Nagai, T.; Ichinohashi, Y.; Yamada, K.; Ohno, K.; Kikkawa, F.; Toyokuni, S. Maternal molecular hydrogen administration ameliorates rat fetal hippocampal damage caused by in utero ischemia–reperfusion. Free Radic. Biol. Med. 2014, 69, 324–330. [Google Scholar] [CrossRef]
- Yang, L.; Li, D.; Chen, S. Hydrogen water reduces NSE, IL-6, and TNF-α levels in hypoxic-ischemic encephalopathy. Open Med. 2016, 11, 399–406. [Google Scholar] [CrossRef]
- Yang, M.; Dong, Y.; He, Q.; Zhu, P.; Zhuang, Q.; Shen, J.; Zhang, X.; Zhao, M. Hydrogen: A Novel Option in Human Disease Treatment. Oxid. Med. Cell Longev. 2020, 2020, 8384742. [Google Scholar] [CrossRef]
- Huang, C.S.; Kawamura, T.; Toyoda, Y.; Nakao, A. Recent advances in hydrogen research as a therapeutic medical gas. Free Radic. Res. 2010, 44, 971–982. [Google Scholar] [CrossRef] [PubMed]
- Abraini, J.H.; Gardette-Chauffour, M.C.; Martinez, E.; Rostain, J.C.; Lemaire, C. Psychophysiological reactions in humans during an open sea dive to 500 m with a hydrogen-helium-oxygen mixture. J. Appl. Physiol. 1994, 76, 1113–1118. [Google Scholar] [CrossRef]
- Fontanari, P.; Badier, M.; Guillot, C.; Tomei, C.; Burnet, H.; Gardette, B.; Jammes, Y. Changes in maximal performance of inspiratory and skeletal muscles during and after the 7.1-MPa Hydra 10 record human dive. Eur. J. Appl. Physiol. 2000, 81, 325–328. [Google Scholar] [CrossRef] [PubMed]
- Ono, H.; Nishijima, Y.; Adachi, N.; Sakamoto, M.; Kudo, Y.; Kaneko, K.; Nakao, A.; Imaoka, T. A basic study on molecular hydrogen (H2) inhalation in acute cerebral ischemia patients for safety check with physiological parameters and measurement of blood H2 level. Med. Gas Res. 2012, 2, 1–7. [Google Scholar] [CrossRef][Green Version]
- Ohsawa, I.; Nishimaki, K.; Yamagata, K.; Ishikawa, M.; Ohta, S. Consumption of hydrogen water prevents atherosclerosis in apolipoprotein E knockout mice. Biochem. Biophys. Res. Commun. 2008, 377, 1195–1198. [Google Scholar] [CrossRef]
- Nagata, K.; Nakashima-Kamimura, N.; Mikami, T.; Ohsawa, I.; Ohta, S. Consumption of molecular hydrogen prevents the stress-induced impairments in hippocampus-dependent learning tasks during chronic physical restraint in mice. Neuropsychopharmacology 2009, 34, 501–508. [Google Scholar] [CrossRef][Green Version]
- Sobue, S.; Yamai, K.; Ito, M.; Ohno, K.; Ito, M.; Iwamoto, T.; Ichihara, M. Simultaneous oral and inhalational intake of molecular hydrogen additively suppresses signaling pathways in rodents. Mol. Cell. Biochem. 2015, 403, 231–241. [Google Scholar] [CrossRef]
- Liu, Y.; Liu, W.; Sun, X.; Li, R.; Sun, Q.; Cai, J.; Zhang, W. Hydrogen saline offers neuroprotection by reducing oxidative stress in a focal cerebral ischemia-reperfusion rat model. Med. Gas. Res. 2011, 1, 1–9. [Google Scholar] [CrossRef][Green Version]
- Grochowska, M.; Laskus, T.; Radkowski, M. Gut microbiota in neurological disorders. Arch. Immunol. Ther. Exp. 2019, 67, 375–383. [Google Scholar] [CrossRef][Green Version]
- Baird, L.; Dinkova-Kostova, A.T. The cytoprotective role of the Keap1–Nrf2 pathway. Arch. Toxicol. 2011, 85, 241–272. [Google Scholar] [CrossRef] [PubMed]
- Katoh, Y.; Itoh, K.; Yoshida, E.; Miyagishi, M.; Fukamizu, A.; Yamamoto, M. Two domains of Nrf2 cooperatively bind CBP, a CREB binding protein, and synergistically activate transcription. Genes Cells 2001, 6, 857–868. [Google Scholar] [CrossRef] [PubMed]
- Guo, X.; Han, C.; Ma, K.; Xia, Y.; Wan, F.; Yin, S.; Kou, L.; Sun, Y.; Wu, J.; Hu, J.; et al. Hydralazine protects nigrostriatal dopaminergic neurons from MPP+ and MPTP induced neurotoxicity: Roles of Nrf2-ARE signaling pathway. Front. Neurol. 2019, 10, 271. [Google Scholar] [CrossRef] [PubMed]
- Oh, S.; Shimizu, H.; Satoh, T.; Okada, S.; Adachi, S.; Inoue, K.; Eguchi, H.; Yamamoto, M.; Imaki, T.; Hashimoto, K.; et al. Identification of nesfatin-1 as a satiety molecule in the hypothalamus. Nature 2006, 443, 709–712. [Google Scholar] [CrossRef] [PubMed]
- Lim, Y.W. Triple endobutton technique in acromioclavicular joint reduction and reconstruction. Ann. Acad. Med. Singap. 2008, 37, 294. [Google Scholar]
- Buendia, I.; Michalska, P.; Navarro, E.; Gameiro, I.; Egea, J.; León, R.J. Therapeutics, Nrf2–ARE pathway: An emerging target against oxidative stress and neuroinflammation in neurodegenerative diseases. Clin. Pharm. Therap. 2016, 157, 84–104. [Google Scholar]
- Sivandzade, F.; Prasad, S.; Bhalerao, A.; Cucullo, L.J. NRF2 and NF-қB interplay in cerebrovascular and neurodegenerative disorders: Molecular mechanisms and possible therapeutic approaches. Redox Biol. 2019, 21, 101059. [Google Scholar] [CrossRef]
- Jakel, R.J.; Townsend, J.A.; Kraft, A.D.; Johnson, J.A. Nrf2-mediated protection against 6-hydroxydopamine. Brain Res. 2007, 1144, 192–201. [Google Scholar] [CrossRef][Green Version]
- Innamorato, N.G.; Jazwa, A.; Rojo, A.I.; García, C.; Fernández-Ruiz, J.; Grochot–Przeczek, A.; Stachurska, A.; Jozkowicz, A.; Dulak, J.; Cuadrado, A. Different susceptibility to the Parkinson’s toxin MPTP in mice lacking the redox master regulator Nrf2 or its target gene heme oxygenase-1. PLoS ONE 2010, 5, e11838. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Wang, F.; Yu, G.; Liu, S.Y.; Li, J.B.; Wang, J.F.; Bo, L.L.; Qian, L.R.; Sun, X.J.; Deng, X.M. Hydrogen-rich saline protects against renal ischemia/reperfusion injury in rats. J. Surg. Res. 2011, 167, e339–e344. [Google Scholar] [CrossRef] [PubMed]
- Huang, L.; Lenahan, C.; Boling, W.; Tang, J.; Zhang, J.H. Molecular hydrogen application in stroke: Bench to bedside. Curr. Pharm. Des. 2021, 27, 1–9. [Google Scholar] [CrossRef]
- Manaenko, A.; Lekic, T.; Ma, Q.; Zhang, J.; Tang, J. Hydrogen inhalation ameliorated mast cell mediated brain injury after ICH in mice. Crit. Care Med. 2013, 41, 1266. [Google Scholar] [CrossRef][Green Version]
- Yuan, L.; Shen, J. Hydrogen, a potential safeguard for graft-versus-host disease and graft ischemia-reperfusion injury? Clinics 2016, 71, 544–549. [Google Scholar] [CrossRef]
- Liu, Q.; Shen, W.F.; Sun, H.Y.; Fan, D.F.; Nakao, A.; Cai, J.M.; Yan, G.; Zhou, W.P.; Shen, R.X.; Yang, J.M.; et al. Hydrogen-rich saline protects against liver injury in rats with obstructive jaundice. Liver Int. 2010, 30, 958–968. [Google Scholar] [CrossRef]
- Choi, J.; An, E.S.; Ban, Y.H.; Seo, D.W.; Kim, T.S.; Lee, S.P.; Kim, Y.B. Hydrogen-enriched water eliminates fine particles from the lungs and blood by enhancing phagocytic activity. J. Biomed. Res. 2017, 31, 503–511. [Google Scholar]
- Nishida, T.; Hayashi, T.; Inamoto, T.; Kato, R.; Ibuki, N.; Takahara, K.; Tanda, N. Dual gas treatment with hydrogen and carbon monoxide attenuates oxidative stress and protects from renal ischemia-reperfusion injury. Transplant. Proc. 2018, 1, 250–258. [Google Scholar] [CrossRef]
- Nishimaki, K.; Asada, T.; Ohsawa, I.; Nakajima, E.; Ikejima, C.; Yokota, T.; Ohta, S. Effects of molecular hydrogen assessed by an animal model and a randomized clinical study on mild cognitive impairment. Curr. Alzheimer Res. 2018, 15, 482–492. [Google Scholar] [CrossRef][Green Version]
- Hayashi, T.; Yoshioka, T.; Hasegawa, K.; Miyamura, M.; Mori, T.; Ukimura, A.; Ishizaka, N. Inhalation of hydrogen gas attenuates left ventricular remodeling induced by intermittent hypoxia in mice. Am. J. Physiol. 2011, 301, H1062–H1069. [Google Scholar] [CrossRef][Green Version]
- Tamaki, N.; Orihuela-Campos, R.C.; Fukui, M.; Ito, H.O. Hydrogen-rich water intake accelerates oral palatal wound healing via activation of the Nrf2/antioxidant defense pathways in a rat model. Oxid. Med. Cell Longev. 2016, 2016, 5679040. [Google Scholar] [CrossRef][Green Version]
- Zhou, P.; Lin, B.; Wang, P.; Pan, T.; Wang, S.; Chen, W.; Liu, S. The healing effect of hydrogen-rich water on acute radiation-induced skin injury in rats. J. Radiat. Res. 2019, 60, 17–22. [Google Scholar] [CrossRef] [PubMed]
- Ostojic, S.M. Does H2 alter mitochondrial bioenergetics via GHS-R1α activation? Theranostics 2017, 7, 1330–1332. [Google Scholar] [CrossRef][Green Version]
- Kamimura, N.; Nishimaki, K.; Ohsawa, I.; Ohta, S. Molecular hydrogen improves obesity and diabetes by inducing hepatic FGF21 and stimulating energy metabolism in db/db mice. Obesity 2011, 19, 1396–1403. [Google Scholar] [CrossRef] [PubMed]
- Yoritaka, A.; Ohtsuka, C.; Maeda, T.; Hirayama, M.; Abe, T.; Watanabe, H.; Hatano, T. Randomized, double-blind, multicenter trial of hydrogen water for Parkinson’s disease. Mov. Disord. Clin. Pract. 2018, 33, 1505–1507. [Google Scholar] [CrossRef] [PubMed]
- Yoritaka, A.; Abe, T.; Ohtsuka, C.; Maeda, T.; Hirayama, M.; Watanabe, H.; Hatano, T. A randomized double-blind multi-center trial of hydrogen water for Parkinson’s disease: Protocol and baseline characteristics. BMC Neurol. 2016, 16, 66. [Google Scholar] [CrossRef][Green Version]
- Lin, C.P.; Chuang, W.C.; Lu, F.J.; Chen, C.Y. Anti-oxidant and anti-inflammatory effects of hydrogen-rich water alleviate ethanol-induced fatty liver in mice. World J. Gastroenterol. 2017, 23, 4920–4934. [Google Scholar] [CrossRef]
- Kura, B.; Bagchi, A.K.; Singal, P.K.; Barancik, M.; LeBaron, T.W.; Valachova, K.; Šoltés, L.; Slezák, J. Molecular hydrogen: Potential in mitigating oxidative-stress-induced radiation injury. Can. J. Physiol. Pharm. 2018, 97, 287–292. [Google Scholar] [CrossRef]
- Yuan, J.; Wang, D.; Liu, Y.; Chen, X.; Zhang, H.; Shen, F.; Liu, X.; Fu, J. Hydrogen-rich water attenuates oxidative stress in rats with traumatic brain injury via Nrf2 pathway. J. Surg. Res. 2018, 228, 238–246. [Google Scholar] [CrossRef]
- Chen, H.G.; Xie, K.L.; Han, H.Z.; Wang, W.N.; Liu, D.Q.; Wang, G.L.; Yu, Y.H. Heme oxygenase-1 mediates the anti-inflammatory effect of molecular hydrogen in LPS-stimulated RAW 264.7 macrophages. Int. J. Surg. 2013, 11, 1060–1066. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Niture, S.K.; Khatri, R.; Jaiswal, A.K. Regulation of Nrf2—An update. Free Radic. Biol. Med. 2014, 66, 36–44. [Google Scholar] [CrossRef][Green Version]
- Gao, Y.; Yang, H.; Fan, Y.; Li, L.; Fang, J.; Yang, W. Hydrogen-rich saline attenuates cardiac and hepatic injury in doxorubicin rat model by inhibiting inflammation and apoptosis. Mediat. Inflamm. 2016, 2016, 1320365. [Google Scholar] [CrossRef]
- Tamura, T.; Hayashida, K.; Sano, M.; Onuki, S.; Suzuki, M. Efficacy of inhaled hydrogen on neurological outcome following brain ischemia during post-cardiac arrest care (HYBRID II trial): Study protocol for a randomized controlled trial. Trials 2017, 18, 1–9. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Haam, S.; Lee, J.G.; Paik, H.C.; Park, M.S.; Lim, B.J. Hydrogen gas inhalation during ex vivo lung perfusion of donor lungs recovered after cardiac death. J. Heart. Lung Transplant. 2018, 37, 1271–1278. [Google Scholar] [CrossRef]
- Abisso, T.G.; Adzavon, Y.M.; Zhao, P.; Zhang, X.; Liu, M.; Ma, X. Current progress in molecular hydrogen medication: Protective and therapeutic uses of hydrogen against different disease scenarios. Intern. Med. 2020, 10, 314. [Google Scholar]
- Imai, K.; Kotani, T.; Tsuda, H.; Mano, Y.; Nakano, T.; Ushida, T.; Hirakawa, A. Neuroprotective potential of molecular hydrogen against perinatal brain injury via suppression of activated microglia. Free Radic. Biol. Med. 2016, 91, 154–163. [Google Scholar] [CrossRef] [PubMed]
- He, J.; Xiong, S.; Zhang, J.; Wang, J.; Sun, A.; Mei, X.; Wang, Q. Protective effects of hydrogen-rich saline on ulcerative colitis rat model. J. Surg. Res. 2013, 185, 174–181. [Google Scholar] [CrossRef]
- Chen, C.H.; Manaenko, A.; Zhan, Y.; Liu, W.W.; Ostrowki, R.P.; Tang, J.; Zhang, J.H. Hydrogen gas reduced acute hyperglycemia-enhanced hemorrhagic transformation in a focal ischemia rat model. Neuroscience 2010, 169, 402–414. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Sato, Y.; Kajiyama, S.; Amano, A.; Kondo, Y.; Sasaki, T.; Handa, S.; Fujinawa, H. Hydrogen-rich pure water prevents superoxide formation in brain slices of vitamin C-depleted SMP30/GNL knockout mice. Biochem. Biophys. Res. Commun. 2008, 375, 346–350. [Google Scholar] [CrossRef]
- Nakayama, M.; Nakano, H.; Hamada, H.; Itami, N.; Nakazawa, R.; Ito, S.A. Novel bioactive haemodialysis system using dissolved dihydrogen (H2) produced by water electrolysis: A clinical trial. Nephrol. Dial. Transplant. 2010, 25, 3026–3033. [Google Scholar] [CrossRef][Green Version]
- Domoki, F.; Oláh, O.; Zimmermann, A.; Németh, I.; Tóth-Szűki, V.; Hugyecz, M.; Bari, F. Hydrogen is neuroprotective and preserves cerebrovascular reactivity in asphyxiated newborn pigs. Pediatr. Res. 2010, 68, 387–392. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Fujita, K.; Seike, T.; Yutsudo, N.; Ohno, M.; Yamada, H.; Yamaguchi, H.; Katafuchi, T. Hydrogen in drinking water reduces dopaminergic neuronal loss in the 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine mouse model of Parkinson’s disease. PLoS ONE 2009, 4, e7247. [Google Scholar] [CrossRef][Green Version]
- Fu, Y.; Ito, M.; Fujita, Y.; Ito, M.; Ichihara, M.; Masuda, A.; Ohsawa, I. Molecular hydrogen is protective against 6-hydroxydopamine-induced nigrostriatal degeneration in a rat model of Parkinson’s disease. Neurosci. Lett. 2009, 453, 81–85. [Google Scholar] [CrossRef] [PubMed]
- Jucker, M.; Walker, L.C. Pathogenic protein seeding in Alzheimer disease and other neurodegenerative disorders. Ann. Neurol. 2011, 70, 532–540. [Google Scholar] [CrossRef] [PubMed]
- Li, J.; Wang, C.; Zhang, J.H.; Cai, J.M.; Cao, Y.P.; Sun, X.J. Hydrogen-rich saline improves memory function in a rat model of amyloid-beta-induced Alzheimer’s disease by reduction of oxidative stress. Brain Res. 2010, 1328, 152–161. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Wang, C.; Li, J.; Liu, Q.; Yang, R.; Zhang, J.H.; Cao, Y.P.; Sun, X.J. Hydrogen-rich saline reduces oxidative stress and inflammation by inhibit of JNK and NF-κB activation in a rat model of amyloid-beta-induced Alzheimer’s disease. Neurosci. Lett. 2011, 491, 127–132. [Google Scholar] [CrossRef] [PubMed]
- Noe, E.; Ferri, J.; Colomer, C.; Moliner, B.; Chirivella, J. APOE genotype and verbal memory recovery during and after emergence from post-traumatic amnesia. Brain Inj. 2010, 24, 886–892. [Google Scholar] [CrossRef] [PubMed]
- Kubota, M.; Shimmura, S.; Kubota, S.; Miyashita, H.; Kato, N.; Noda, K.; Ozawa, Y.; Usui, T.; Ishida, S.; Umezawa, K.; et al. Hydrogen and N-acetyl-L-cysteine rescue oxidative stress-induced angiogenesis in a mouse corneal alkali-burn model. Investig. Ophthal. Vis. Sci. 2011, 52, 427–433. [Google Scholar] [CrossRef][Green Version]
- Chen, C.; Chen, Q.; Mao, Y.; Xu, S.; Xia, C.; Shi, X.; Sun, X. Hydrogen-rich saline protects against spinal cord injury in rats. Neurochem. Res. 2010, 35, 1111–1118. [Google Scholar] [CrossRef] [PubMed]
- Eckermann, J.M.; Chen, W.; Jadhav, V.; Hsu, F.P.; Colohan, A.R.; Tang, J.; Zhang, J.H. Hydrogen is neuroprotective against surgically induced brain injury. Med. Gas. Res. 2011, 1, 7. [Google Scholar] [CrossRef][Green Version]
- Huang, Y.; Xie, K.; Li, J.; Xu, N.; Gong, G.; Wang, G.; Xiong, L. Beneficial effects of hydrogen gas against spinal cord ischemia–reperfusion injury in rabbits. Brain Res. 2011, 1378, 125–136. [Google Scholar] [CrossRef]
- Matchett, G.A.; Fathali, N.; Hasegawa, Y.; Jadhav, V.; Ostrowski, R.P.; Martin, R.D.; Dorotta, I.R.; Sun, X.; Zhang, J.H. Hydrogen gas is ineffective in moderate and severe neonatal hypoxia–ischemia rat models. Brain Res. 2009, 1259, 90–97. [Google Scholar] [CrossRef] [PubMed]
- Ono, H.; Nishijima, Y.; Adachi, N.; Tachibana, S.; Chitoku, S.; Mukaihara, S.; Nawashiro, H. Improved brain MRI indices in the acute brain stem infarct sites treated with hydroxyl radical scavengers, edaravone and hydrogen, as compared to edaravone alone. A non-controlled study. Med. Gas. Res. 2011, 1, 1–9. [Google Scholar] [CrossRef][Green Version]
- Oharazawa, H.; Igarashi, T.; Yokota, T.; Fujii, H.; Suzuki, H.; Machide, M.; Ohsawa, I. Protection of the retina by rapid diffusion of hydrogen: Administration of hydrogen-loaded eye drops in retinal ischemia–reperfusion injury. Investig. Ophthalmol. Vis. Sci. 2010, 51, 487–492. [Google Scholar] [CrossRef] [PubMed]
- Taura, A.; Kikkawa, Y.S.; Nakagawa, T.; Ito, J. Hydrogen protects vestibular hair cells from free radicals. Acta. Otolaryngol. 2010, 130, 95–100. [Google Scholar] [CrossRef] [PubMed]
- Lin, Y.; Kashio, A.; Sakamoto, T.; Suzukawa, K.; Kakigi, A.; Yamasoba, T. Hydrogen in drinking water attenuates noise-induced hearing loss in guinea pigs. Neurosci. Lett. 2011, 487, 12–16. [Google Scholar] [CrossRef]
- Terasaki, Y.; Ohsawa, I.; Terasaki, M.; Takahashi, M.; Kunugi, S.; Dedong, K.; Ishikawa, A. Hydrogen therapy attenuates irradiation-induced lung damage by reducing oxidative stress. Am. J. Physiol. Lung Cell. Mol. Physiol. 2011, 301, L415–L426. [Google Scholar] [CrossRef][Green Version]
- Qian, L.; Cao, F.; Cui, J.; Wang, Y.; Huang, Y.; Chuai, Y.; Cai, J. The potential cardio protective effects of hydrogen in irradiated mice. J. Radiat. Res. 2010, 51, 741–747. [Google Scholar] [CrossRef][Green Version]
- Kawamura, T.; Wakabayashi, N.; Shigemura, N.; Huang, C.S.; Masutani, K.; Tanaka, Y.; Okumura, M. Inhaled hydrogen gas therapy for prevention of lung transplant-induced ischemia/reperfusion injury in rats. Asthma. Res. Pract. 2010, 90, 1344–1351. [Google Scholar]
- Fang, Y.; Fu, X.J.; Gu, C.; Xu, P.; Wang, Y.; Yu, W.R.; Yao, M. Hydrogen-rich saline protects against acute lung injury induced by extensive burn in rat model. J. Burn. Care Res. 2011, 32, e82–e91. [Google Scholar] [CrossRef]
- Fukuda, K.I.; Asoh, S.; Ishikawa, M.; Yamamoto, Y.; Ohsawa, I.; Ohta, S. Inhalation of hydrogen gas suppresses hepatic injury caused by ischemia/reperfusion through reducing oxidative stress. Biochem. Biophys. Res. Commun. 2007, 361, 670–674. [Google Scholar] [CrossRef]
- Cardinal, J.S.; Zhan, J.; Wang, Y.; Sugimoto, R.; Tsung, A.; McCurry, K.R.; Nakao, A. Oral hydrogen water prevents chronic allograft nephropathy in rats. Kidney Int. 2010, 77, 101–109. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Li, Y.; Hamasaki, T.; Nakamichi, N.; Kashiwagi, T.; Komatsu, T.; Ye, J.; Teruya, K.; Abe, M.; Yan, H.; Kinjo, T.; et al. Suppressive effects of electrolyzed reduced water on alloxan-induced apoptosis and type 1 diabetes mellitus. Cytotechnology 2011, 63, 119–131. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Kajiyama, S.; Hasegawa, G.; Asano, M.; Hosoda, H.; Fukui, M.; Nakamura, N.; Adachi, T. Supplementation of hydrogen-rich water improves lipid and glucose metabolism in patients with type 2 diabetes or impaired glucose tolerance. Nutr. Res. 2008, 28, 137–143. [Google Scholar] [CrossRef] [PubMed]
- Ahearne, C.E.; Boylan, G.B.; Murray, D.M. Short and long term prognosis in perinatal asphyxia: An update. World. J. Clin. Pediatr. 2016, 5, 67–74. [Google Scholar] [CrossRef]
- Kriz, J. Inflammation in ischemic brain injury: Timing is important. Crit. Rev. Neurobiol. 2006, 18, 145–157. [Google Scholar] [CrossRef]
- Cai, J.; Kang, Z.; Liu, W.W.; Luo, X.; Qiang, S.; Zhang, J.H.; Li, R. Hydrogen therapy reduces apoptosis in neonatal hypoxia–ischemia rat model. Neurosci. Lett. 2008, 441, 167–172. [Google Scholar] [CrossRef]
- Cai, J.; Kang, Z.; Liu, K.; Liu, W.; Li, R.; Zhang, J.H.; Sun, X. Neuroprotective effects of hydrogen saline in neonatal hypoxia–ischemia rat model. Brain Res. 2009, 1256, 129–137. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Oláh, O.; Tóth-Szűki, V.; Temesvári, P.; Bari, F.; Domoki, F. Delayed neurovascular dysfunction is alleviated by hydrogen in asphyxiated newborn pigs. Neonatology 2013, 104, 79–86. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Kharitonenkov, A.; Shiyanova, T.L.; Koester, A.; Ford, A.M.; Micanovic, R.; Galbreath, E.J.; Sandusky, G.E.; Hammond, L.J.; Moyers, J.S.; Owens, R.A.; et al. FGF-21 as a novel metabolic regulator. J. Clin. Investig. 2005, 115, 1627–1635. [Google Scholar] [CrossRef][Green Version]
- Kalkman, C.J.; Peelen, L.; Moons, K.G.; Veenhuizen, M.; Bruens, M.; Sinnema, G.; de Jong, T.P. Behavior and development in children and age at the time of first anesthetic exposure. Anesthesiology 2009, 110, 805–812. [Google Scholar] [CrossRef][Green Version]
- Yonamine, R.; Satoh, Y.; Kodama, M.; Araki, Y.; Kazama, T. Coadministration of hydrogen gas as part of the carrier gas mixture suppresses neuronal apoptosis and subsequent behavioral deficits caused by neonatal exposure to sevoflurane in mice. Anesthesiology 2013, 118, 105–113. [Google Scholar] [CrossRef][Green Version]
- Takaenoki, Y.; Satoh, Y.; Araki, Y.; Kodama, M.; Yonamine, R.; Yufune, S.; Kazama, T. Neonatal exposure to sevoflurane in mice causes deficits in maternal behavior later in adulthood. Anesthesiology 2014, 120, 403–415. [Google Scholar] [CrossRef]
- JazvinšćakJembrek, M.; Hof, P.R.; Šimić, G. Ceramides in Alzheimer’s disease: Key mediators of neuronal apoptosis induced by oxidative stress and Aβ accumulation. Oxid. Med. CellLongev. 2015, 2015, 346783. [Google Scholar]
- Wang, X.; Wang, W.; Li, L.; Perry, G.; Lee, H.G.; Zhu, X. Oxidative stress and mitochondrial dysfunction in Alzheimer’s disease. Biochim. Biophys. Acta 2014, 1842, 1240–1247. [Google Scholar] [CrossRef][Green Version]
- Lasagna-Reeves, C.A.; Castillo-Carranza, D.L.; Sengupta, U.; Clos, A.L.; Jackson, G.R.; Kayed, R. Tau oligomers impair memory and induce synaptic and mitochondrial dysfunction in wild-type mice. Mol. Neurodegener. 2011, 6, 39. [Google Scholar] [CrossRef][Green Version]
- Tan, M.S.; Yu, J.T.; Jiang, T.; Zhu, X.C.; Tan, L. The NLRP3 inflammasome in Alzheimer’s disease. Mol. Neurobiol. 2013, 48, 875–882. [Google Scholar] [CrossRef] [PubMed]
- Ren, J.D.; Wu, X.B.; Jiang, R.; Hao, D.P.; and Liu, Y. Molecular hydrogen inhibits lipopolysaccharide-triggered NLRP3 inflammasome activation in macrophages by targeting the mitochondrial reactive oxygen species. Biochim. Biophys. Acta Mol. Cell Res. 2016, 1863, 50–55. [Google Scholar]
- Lin, C.L.; Huang, W.N.; Li, H.H.; Huang, C.N.; Hsieh, S.; Lai, C.; Lu, F.J. Hydrogen-rich water attenuates amyloid β-induced cytotoxicity through upregulation of Sirt1-FoxO3a by stimulation of AMP-activated protein kinase in SK-N-MC cells. Chem. Biol. Interact. 2015, 240, 12–21. [Google Scholar] [CrossRef]
- Yao, H.; Zhao, D.; Khan, S.H.; Yang, L. Role of autophagy in prion protein-induced neurodegenerative diseases. ActaBiochim. Biophy. Sin. 2013, 45, 494–502. [Google Scholar] [CrossRef][Green Version]
- Henderson, L.E.; Abdelmegeed, M.A.; Yoo, S.H.; Rhee, S.G.; Zhu, X.; Smith, M.A.; Song, B.J. Enhanced phosphorylation of Bax and its translocation into mitochondria in the brains of individuals affiliated with Alzheimer’s disease. Open Neurol. J. 2017, 11, 48–58. [Google Scholar] [CrossRef]
- Han, B.; Zhou, H.; Jia, G.; Wang, Y.; Song, Z.; Wang, G.; Pan, S.; Bai, X.; Lv, J.; Sun, B. MAPK s and Hsc70 are critical to the protective effect of molecular hydrogen during the early phase of acute pancreatitis. FEBS J. 2016, 283, 738–756. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Hou, C.; Peng, Y.; Qin, C.; Fan, F.; Liu, J.; Long, J. Hydrogen-rich water improves cognitive impairment gender-dependently in APP/PS1 mice without affecting Aβ clearance. Free Radic. Res. 2018, 52, 1311–1322. [Google Scholar] [CrossRef]
- Fitzpatrick, J.L.; Mize, A.L.; Wade, C.B.; Harris, J.A.; Shapiro, R.A.; Dorsa, D.M. Estrogen-mediated neuroprotection against β-amyloid toxicity requires expression of estrogen receptor α or β and activation of the MAPK pathway. J. Neurochem. 2002, 82, 674–682. [Google Scholar] [CrossRef][Green Version]
- Hollands, C.; Tobin, M.K.; Hsu, M.; Musaraca, K.; Yu, T.S.; Mishra, R.; Lazarov, O. Depletion of adult neurogenesis exacerbates cognitive deficits in Alzheimer’s disease by compromising hippocampal inhibition. Mol. Neurodegener. 2017, 12, 1–3. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Gu, Y.; Huang, C.S.; Inoue, T.; Yamashita, T.; Ishida, T.; Kang, K.M.; Nakao, A. Drinking hydrogen water ameliorated cognitive impairment in senescence-accelerated mice. J. Clin. Biochem. Nutr. 2010, 46, 269–276. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Alexander, S.; Kerr, M.E.; Kim, Y.; Kamboh, M.I.; Beers, S.R.; Conley, Y.P. Apolipoprotein E4 allele presence and functional outcome after severe traumatic brain injury. J. Neurotrauma 2007, 24, 790–797. [Google Scholar] [CrossRef] [PubMed]
- Osborne, N.N.; Casson, R.J.; Wood, J.P.; Chidlow, G.; Graham, M.; Melena, J. Retinal ischemia: Mechanisms of damage and potential therapeutic strategies. Prog. Retin. Eye Res. 2004, 23, 91–147. [Google Scholar] [CrossRef]
- Kikkawa, Y.S.; Nakagawa, T.; Horie, R.T.; Ito, J. Hydrogen protects auditory hair cells from free radicals. Neuroreport 2009, 20, 689–694. [Google Scholar] [CrossRef]
- Kikkawa, Y.S.; Nakagawa, T.; Taniguchi, M.; Ito, J. Hydrogen protects auditory hair cells from cisplatin-induced free radicals. Neurosci. Lett. 2014, 579, 125–129. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Zhou, Y.; Zheng, H.; Ruan, F.; Chen, X.; Zheng, G.; Kang, M.; Sun, X. Hydrogen-rich saline alleviates experimental noise-induced hearing loss in guinea pigs. Neuroscience 2012, 209, 47–53. [Google Scholar] [CrossRef] [PubMed]
- Rubiano, A.M.; Carney, N.; Chesnut, R.; Puyana, J.C. Global neurotrauma research challenges and opportunities. Nature 2015, 527, S193–S197. [Google Scholar] [CrossRef]
- Ji, X.; Liu, W.; Xie, K.; Liu, W.; Qu, Y.; Chao, X.; Fei, Z. Beneficial effects of hydrogen gas in a rat model of traumatic brain injury via reducing oxidative stress. Brain Res. 2010, 1354, 196–205. [Google Scholar] [CrossRef] [PubMed]
- Dohi, K.; Kraemer, B.C.; Erickson, M.A.; McMillan, P.J.; Kovac, A.; Flachbartova, Z.; Banks, W.A. Molecular hydrogen in drinking water protects against neurodegenerative changes induced by traumatic brain injury. PLoS ONE 2014, 9, e108034. [Google Scholar] [CrossRef][Green Version]
- Liu, F.T.; Xu, S.M.; Xiang, Z.H.; Li, X.N.; Li, J.; Yuan, H.B.; Sun, X.J. Molecular hydrogen suppresses reactive astrogliosis related to oxidative injury during spinal cord injury in rats. CNS. Neurosci. Ther. 2014, 20, 778–786. [Google Scholar] [CrossRef] [PubMed]
- Matsumoto, A.; Yamafuji, M.; Tachibana, T.; Nakabeppu, Y.; Noda, M.; Nakaya, H. Oral ‘hydrogen water’ induces neuroprotective ghrelin secretion in mice. Sci. Rep. 2013, 3, 1–5. [Google Scholar] [CrossRef][Green Version]
- Andrews, Z.B. The extra-hypothalamic actions of ghrelin on neuronal function. Trends Neurosci. 2011, 34, 31–40. [Google Scholar] [CrossRef]
- Kawamura, T.; Wakabayashi, N.; Shigemura, N.; Huang, C.S.; Masutani, K.; Tanaka, Y.; Okumura, M. Hydrogen gas reduces hyperoxic lung injury via the Nrf2 pathway in vivo. Am. J. Physiol. Lung Cell Mol. Physiol. 2013, 304, L646–L656. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Iuchi, K.; Imoto, A.; Kamimura, N.; Nishimaki, K.; Ichimiya, H.; Yokota, T.; Ohta, S. Molecular hydrogen regulates gene expression by modifying the free radical chain reaction-dependent generation of oxidized phospholipid mediators. Sci. Rep. 2016, 6, 1–12. [Google Scholar] [CrossRef][Green Version]
- Landucci, G.; Tugnoli, A.; Cozzani, V. Inherent safety key performance indicators for hydrogen storage systems. J. Hazard Mater. 2008, 159, 554–566. [Google Scholar] [CrossRef] [PubMed]
- Ostojic, S.M. Molecular hydrogen: An inert gas turns clinically effective. Ann. Med. 2015, 47, 301–304. [Google Scholar] [CrossRef] [PubMed]
- Li, H.M.; Shen, L.; Ge, J.W.; Zhang, R.F. The transfer of hydrogen from inert gas to therapeutic gas. Med. Gas. Res. 2017, 7, 265. [Google Scholar] [PubMed]